聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
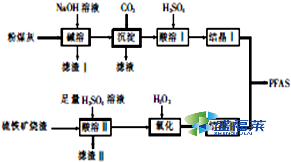
粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3,再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体.硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS.
(1)氧化铝为两性氧化物,“碱溶”时Al2O3发生反应的滤渣化学方程式为:Al2O3+2OH-=2AlO2-+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,滤渣Ⅰ的主要成分为Fe2O3、FeO,为充分利用Fe元素,将滤渣I与硫铁矿烧渣一起用硫酸溶解加以利用,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Fe2O3、FeO;与硫铁矿烧渣一起用硫酸溶解加以利用;
(2)通入二氧化碳后得到氢氧化铝沉淀,滤液中主要含有NaHCO3;氢氧化铝用硫酸溶解得到酸溶Ⅰ的溶质为Al2(SO4)3,
故答案为:NaHCO3;Al2(SO4)3;
(3)H2O2将Fe2+为Fe3+,“氧化”时应控制温度不超过57℃,其原因是温度过高,H2O2会分解,
故答案为:温度过高,H2O2会分解;
(4)聚合硫酸铝铁溶于电离出Fe3+、Al3+,Fe3+、Al3+水解生成氢氧化铝胶体和氢氧化铁胶体,具有吸附性,吸附悬浮物质而净水;
因为Fe3+、Al3+水解均呈酸性,所以产品PFAS中硫酸残留过多,会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质,
故答案为:聚合硫酸铝铁溶于电离出Fe3+、Al3+,Fe3+、Al3+水解生成氢氧化铝胶体和氢氧化铁胶体,具有吸附性;会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质;
(5)根据电荷守恒,可知3a+3b=m+2n,
n(OH-)=2n(H2SO4)=0.15L×0.100 mol•L-1×2=0.03mol,
n(SO42-)=n(BaSO4)-n(H2SO4)= 10.485g
233g/mol
-0.15L×0.100 mol•L-1=0.03mol,
已知:I2+2Na2S2O3=2NaI+Na2S4O6,2Fe3++2I-=2Fe2++I2,则2Fe3+~I2~2Na2S2O3,
n(Fe3+)=n(Na2S2O3)=0.02L×0.500 mol•L-1=0.01mol,
在AlaFeb(OH)m(SO4)n中离子所带电荷守恒,
则n(Al3+)= 1
3×(0.03mol+0.03mol×2-0.01mol×3)=0.02mol
8.810g样品中水的质量:m(H2O)=8.810g-0.02mol×27g•mol-1-0.01mol×56 g•mol-1-0.03mol×17 g•mol-1-0.03mol×96 g•mol-1=4.32 g,
则n(H2O)= 4.32g
18g/mol
=0.24mol,
所以n(Al3+):n(Fe3+):n(OH-):n(SO42-):n(H2O)=2:1:3:3:24
则硫酸铝铁的化学式为:Al2Fe(OH)3(SO4)3•24H2O;








